问题1
eccDNA 从哪里来?(基因组来源,Genomic origin)
问题2
eccDNA 是怎么来的?(生物发生,Biogenesis)
问题3
eccDNA 有什么用?(生物学功能,Biological function)
终于,在 eccDNA 首次发现半个多世纪以后,哈佛大学的张毅教授团队在 Nature 杂志上发表了题为“eccDNAs are apoptotic products with high innate immunostimulatory activity”的文章,揭晓了有关 eccDNA 的这三大关键问题的答案。

1、温和裂解
2、去除非目的 DNA
3、环状 DNA 富集
首先,研究者采用了 pH 11.8 的温和碱性细胞裂解液,降低细胞裂解这个步骤当中 eccDNA 的损伤。然后,研究者使用稀有限制酶 PacI 消化线粒体环状 DNA,用专门针对线性 DNA 的外切酶 Plasmid-Safe ATP-dependent DNase 来消化染色质来源的大量线性 DNA。至此,余下的 DNA 大部分都是 eccDNA 了。最后,研究者还在特殊的溶液环境中添加了磁珠吸附的步骤,选择性地吸附 eccDNA,以达到最大限度消除线性 DNA 残留的目的。为了检验这种新方法纯化 eccDNA 的效果,实验团队使用扫描原子力显微镜在微观尺度上进行了直接观察,发现几乎所有纯化后的 DNA 均呈环状,纯化效果远好于传统方法。
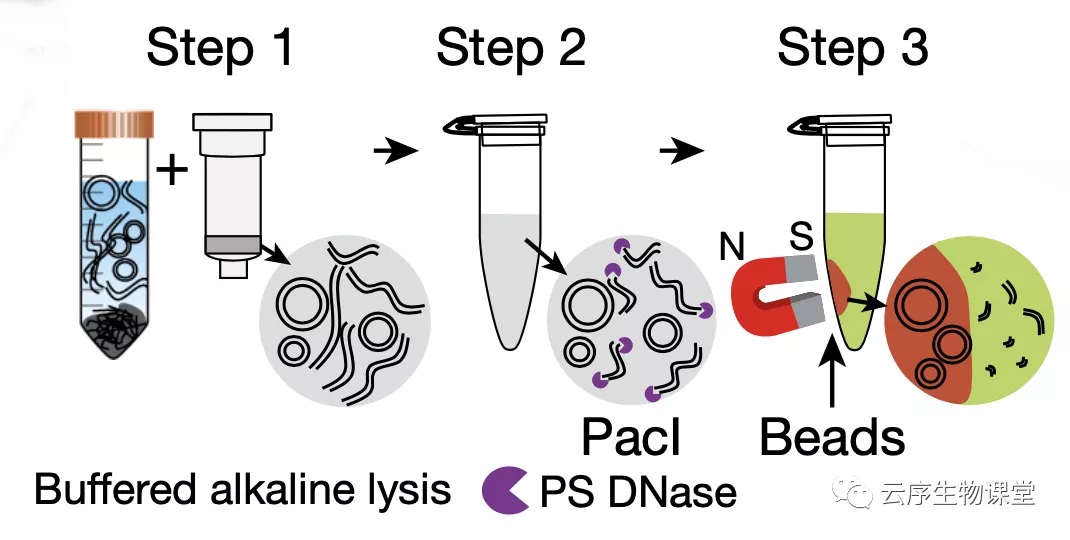

图2 纯化后的eccDNA在原子力显微镜观察下几乎全呈环状
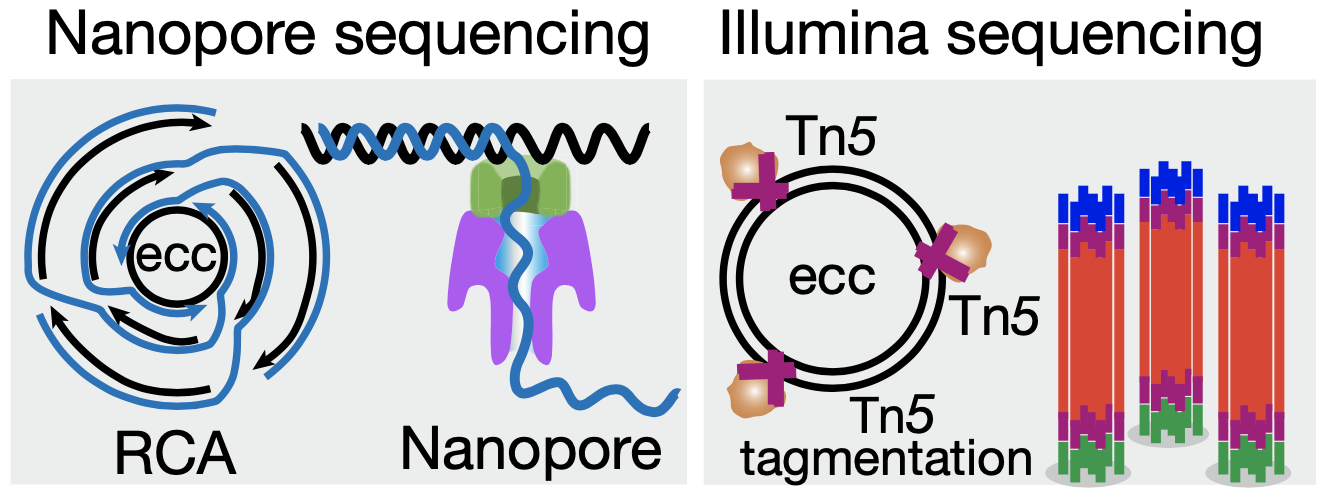
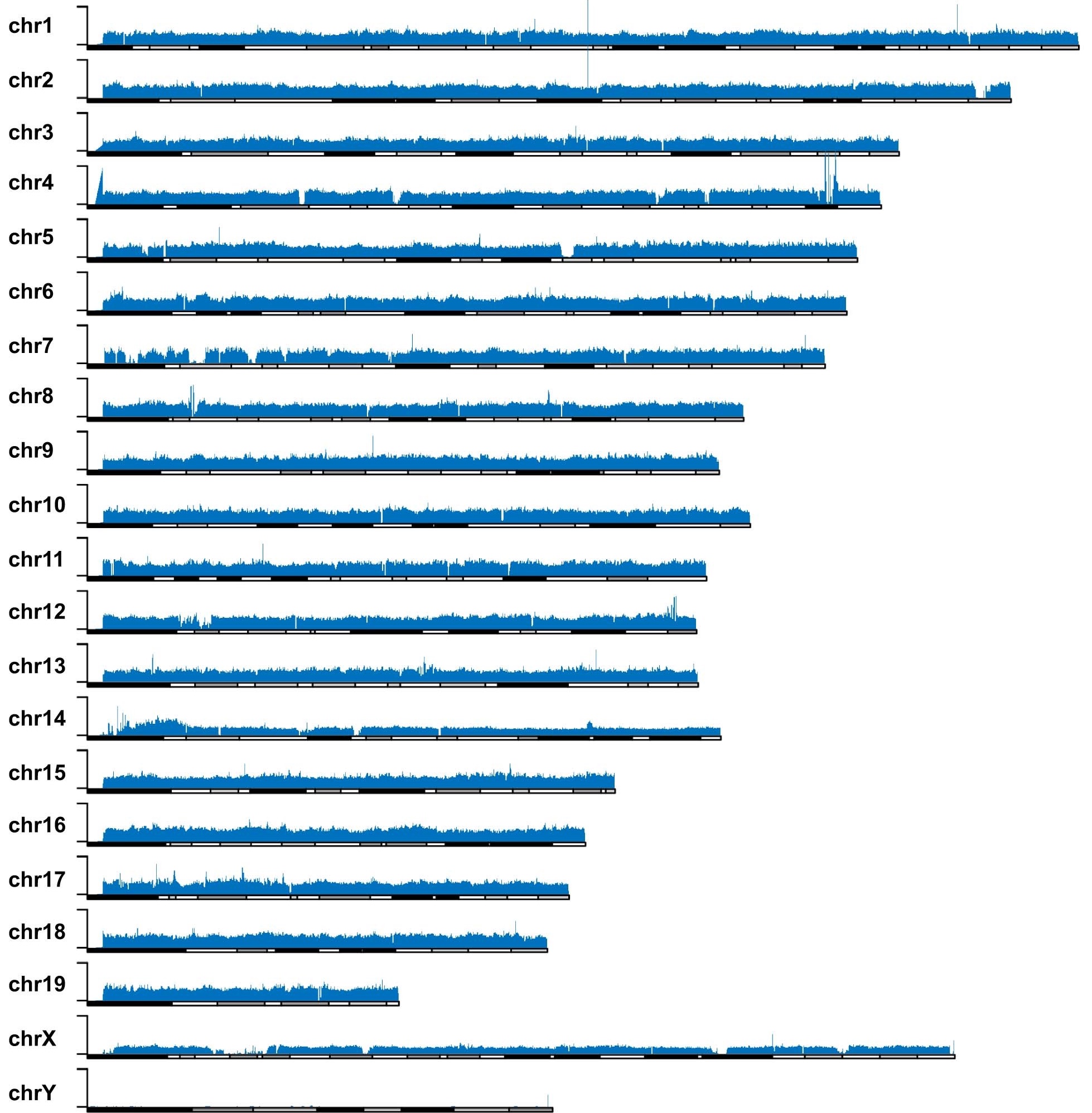
eccDNA 在染色体上广泛均匀分布的特征也得到了第二种测序方法的验证。与第一种方法中使用滚环扩增不同,第二种方法先采用 Tn5 转座酶将 eccDNA 片段化,而后进行常规的 PCR 扩增和 illumina 高通量测序。第二种方法虽然不能得到全读长的 eccDNA,但能避免滚环扩增所造成的小环扩增倍数多、大环扩增倍数少的偏误。综合两种方法的实验结果,研究者确认了“eccDNA 从哪里来”这个问题的答案——eccDNA 的来源序列广泛、随机、均匀地分布于整个基因组上。
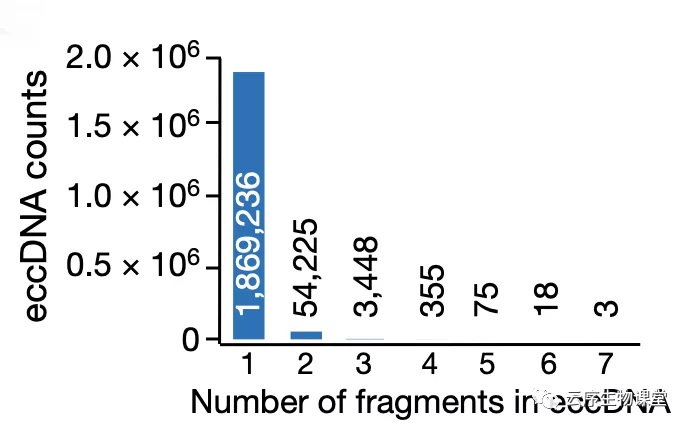
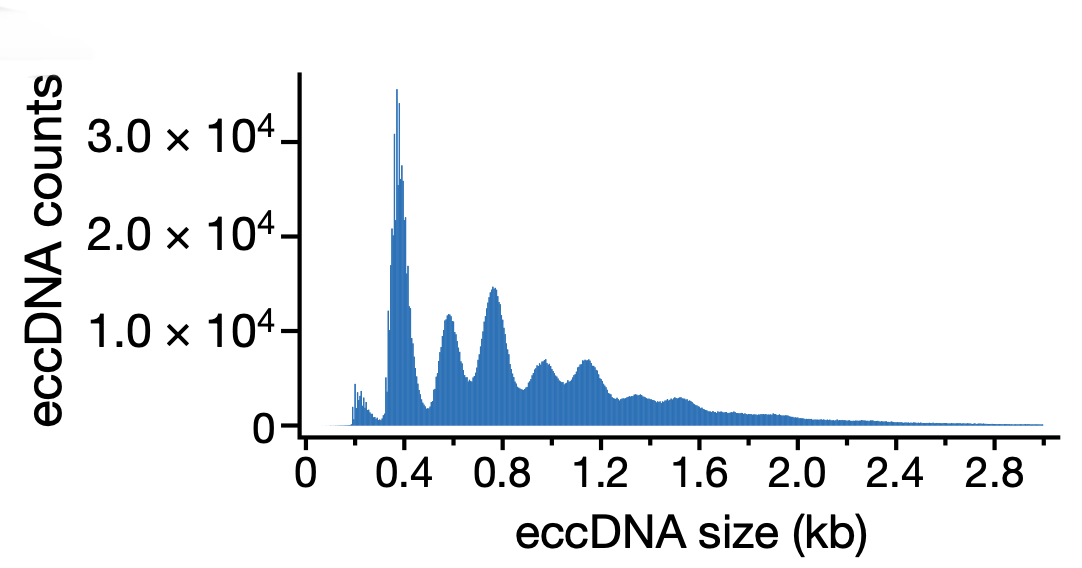
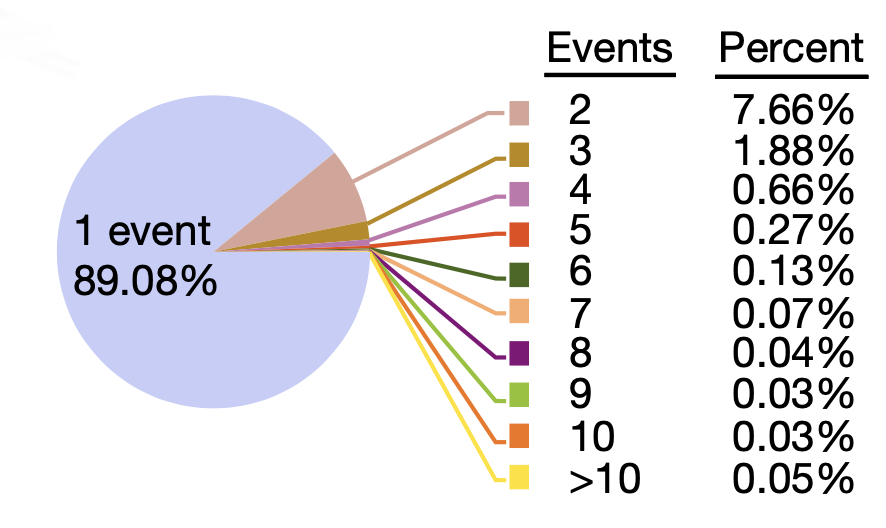
图6 eccDNA 检出次数的分布

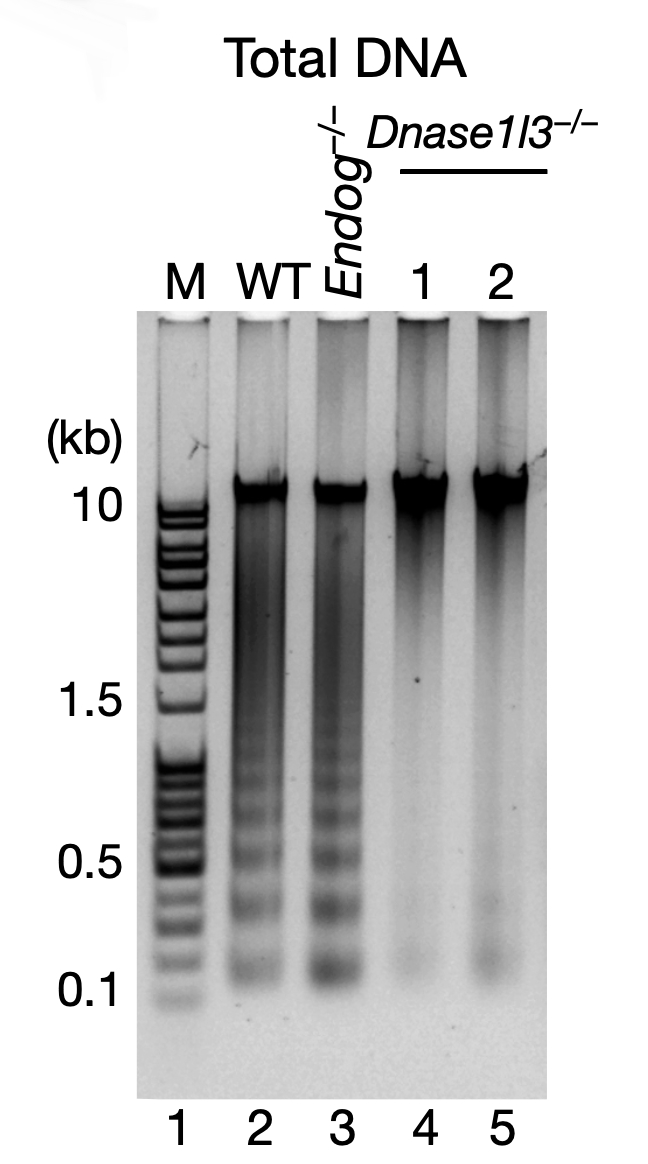
研究者先是尝试使用细胞凋亡诱导剂处理细胞,果然发现了 eccDNA 表达量的增加。研究者随后对凋亡 DNA 片段的形成所需的几种蛋白进行了控制变量的敲除实验,发现对于实验所用的 mESC 细胞而言,当且仅当 DNase γ 的编码基因被敲除时,DNA 的梯度分布现象消失。对于这些 DNase γ 敲除组的细胞而言,即使是施加细胞凋亡的强诱导条件(紫外线),也无法产生 eccDNA。由此可以得出结论:DNase γ 催化产生的凋亡 DNA 片段,是eccDNA 形成的前提条件。
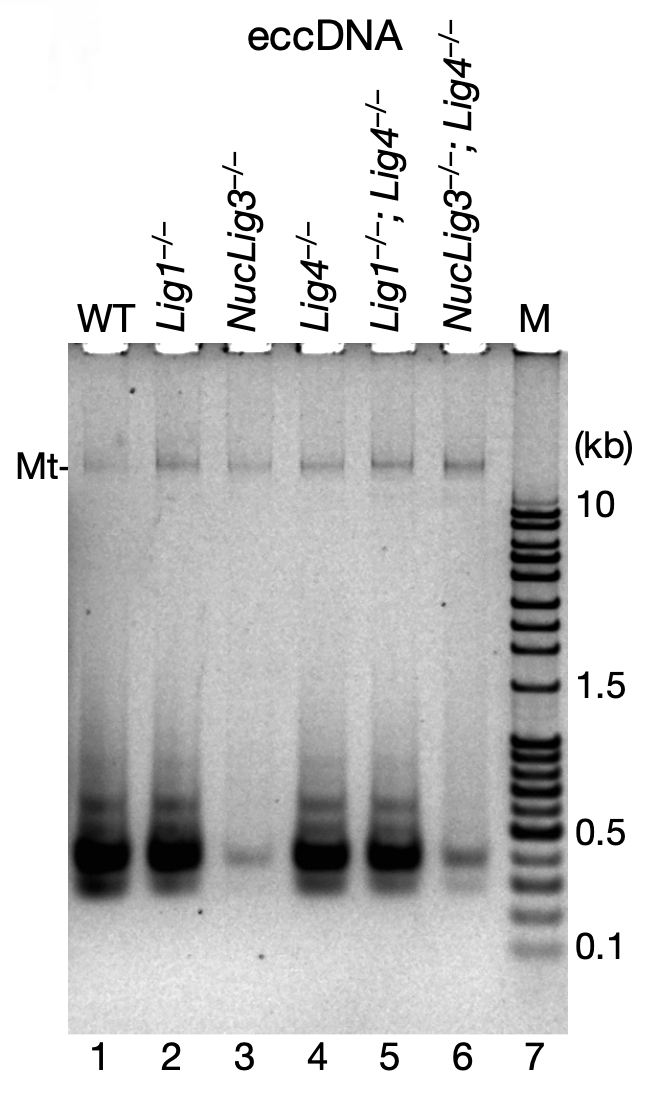
那么,线性的凋亡 DNA 片段又是如何环化为 eccDNA 的呢?哺乳动物具有 Lig1、 Lig3 和 Lig4 三种不同对的DNA 连接酶,研究者这三种酶进行了控制变量的敲除实验,发现对于小鼠 B 淋巴细胞系 CH12F3 而言,当敲除Lig3 时,eccDNA 的水平大减;若同时敲除 Lig3 和 Lig1,甚至具有致死效应;但若仅仅只敲除 Lig1 或Lig1+Lig4,均对 eccDNA 水平无明显影响。由此可以得出结论,Lig3 才是催化 eccDNA 环化的主要酶。
至此,张毅团队勾勒出了 eccDNA 生物发生的基本路径:先由 DNase γ 催化产生凋亡 DNA 片段,然后这些片段在 DNA 连接酶 Lig3 的催化下,或单个片段成环,或多个片段拼接成环,形成 eccDNA。
早前有报道发现,凋亡细胞可刺激免疫反应;另一边厢,也有研究认为,包括 TLR9、HMGB1 在内的先天免疫相关蛋白,对弯折的 DNA 结构(DNA curvatures)具有选择性的亲和力。因为 eccDNA 也具有 DNA 弯折结构,所以研究者大胆猜测:eccDNA 可能因为其空间结构特征而在先天免疫过程中发挥作用。
为了检验上述猜想,研究者培育了骨髓源树突细胞系( bone marrow-derived dendritic cells,简称 BMDC)和骨髓源巨噬细胞系( bone marrow-derived macrophages,简称 BMDM),并分别对这两种细胞各自施加 eccDNA、相同大小基因组线性 DNA 以及相同大小的人工合成 poly(dG:dC) 三种不同的转染刺激。随后的 RT-qPCR 结果显示,无论在 BMDC 还是 BMDM 细胞当中,免疫相关的细胞因子 IFNα/β、IL-6、TNF 的 mRNA 和蛋白质水平在eccDNA 转染组中显著上升,poly(dG:dC) 的刺激效果次之,而线性 DNA 的刺激效果最弱。如果用 Cpf1 酶破坏eccDNA 的环状结构,使其成为开环的线性 DNA,那么 eccNDNA 对这些免疫相关细胞因子的诱导作用将会消除。以上结果强烈暗示,是 eccDNA 的环状结构,赋予了其诱导免疫反应的能力。
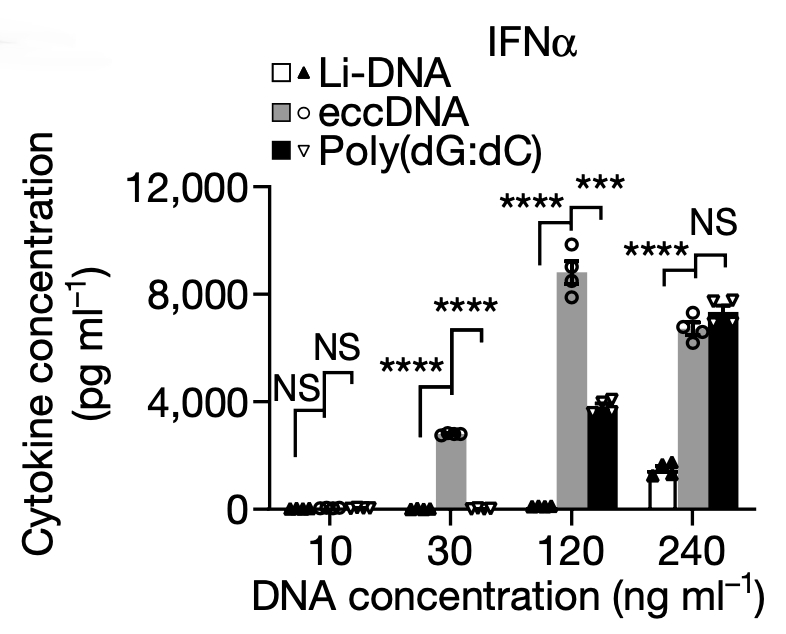
为了进一步验证环状结构的免疫诱导作用,研究者分别人工合成了 200 bp 的环状 DNA 和同样大小的线性DNA,分别转染至 BMDC 细胞中,并检测免疫相关的细胞因子水平,结果人工合成的环状 DNA 果然具有更强的免疫诱导能力。除此以外,研究者还通过引入末端磷硫酰基团( phosphorothioate bonds),来控制人工合成的线性 DNA 与环状 DNA稳定性一致,排除环状 DNA 较强的稳定性对免疫刺激作用所可能造成的潜在影响。综上可证明,eccDNA 是因为其环状结构(而非序列信息)而被赋予了 eccDNA 诱导免疫反应的能力。
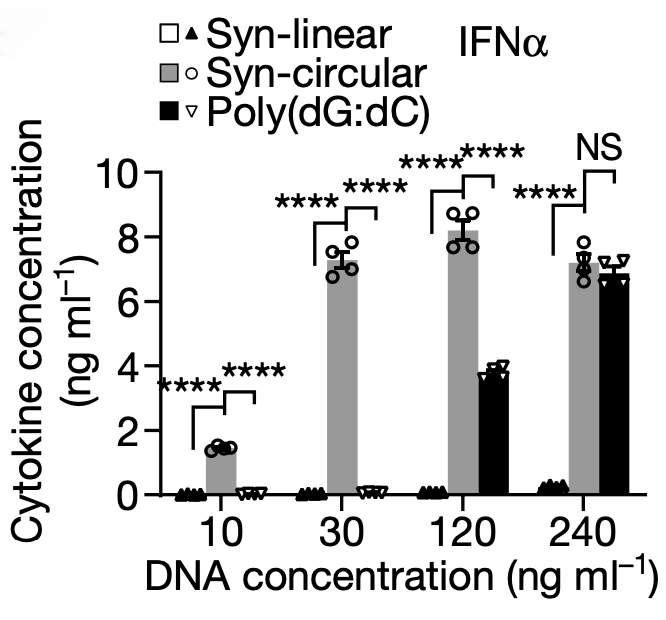
图12 人工合成的环状 DNA 可诱导先天免疫相关细胞因子 IFN α 蛋白水平上升
为了进一步明确 eccDNA 诱导先天免疫反应的分子通路,研究者对 eccDNA 转染的 BMDC 细胞进行了 RNA 测序,发现了有 290 个基因的 mRNA 表达量相比于对照组显著上升,其中包括 34 个细胞因子和趋化因子的基因,且表达量上调幅度最大的 20 个基因当中,有多达 9 个基因属于 I 型 IFN 家族。GO 分析也发现,上调基因富集于免疫功能相关的多个条目当中。为了明确 eccDNA 在免疫反应中是被何种分子探测到的,研究者采用了两种DNA 探测机制缺陷的小鼠细胞系(分别敲除了 Sting1 基因和 Myd88 基因)进行转染实验,并再次进行 RNA 测序。结果显示,在 Sting1 敲除组中,eccDNA 的转染刺激并不能诱导免疫相关基因的 mRNA 水平上升,因此强烈暗示 Sting 通路在先天免疫反应当中负责探测 eccDNA 信号。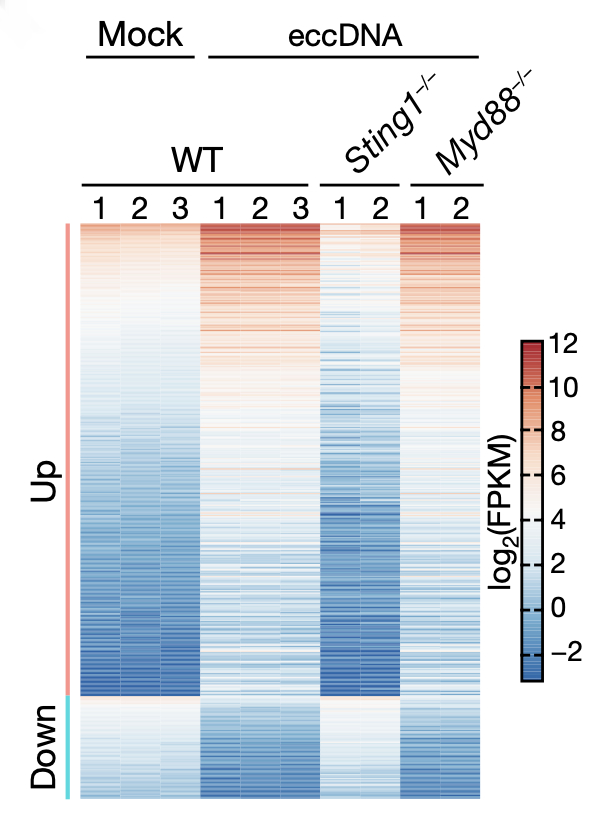
哈佛大学的张毅教授团队在 Nature 杂志上发表的这篇论文,在改进 eccDNA 分离纯化技术的基础上,设计了大量的细胞实验,逻辑缜密、逐层递进、一气呵成,终于回答了半个多世纪以来的 eccDNA 研究一直未能回答的三大关键问题。经此文拨云见日,我们终于知晓:
答案1
eccDNA 的来源序列广泛、随机、均匀地分布于整个基因组上。
答案2
eccDNA 的生物发生,先需要 DNase γ 催化产生凋亡 DNA 片段,然后 Lig3 催化成环。
答案3
eccDNA 因其环状结构而诱导先天免疫反应,Sting 通路负责探测 eccDNA 信号。近年来,由于实验技术和生信分析技术的进步,eccDNA 相关研究发表 SCI 论文的数量呈井喷之势增长。PubMed 搜索数据显示,2017 年 eccDNA 相关论文全世界仅 4 篇,后续几年逐步增长为 6、7、10 篇,而到了现在的 2021 年,仅前十个月,就已经有 15 篇 eccDNA 相关论文见刊,其中还不乏 Nature、Methods in Molecular Biology、Nucleic Acids Research、Molecular Cancer 等高分期刊。见微知著,eccDNA 虽小,但很可能成为下一个生命科学的科研热点。
云序生物是国内最早提供 eccDNA 测序服务的公司,云序在2018年已就启动了组织细胞 eccDNA 测序服务的开发,随后又在国内首发血清血浆环状 DNA 测序服务。迄今为止,我们已经完成上千例样品的 eccDNA 测序,积累了丰富的项目经验,样品类型涵盖:组织﹑细胞﹑血清﹑血浆﹑尿液等,物种涵盖:人﹑小鼠﹑大鼠﹑拟南芥﹑果蝇﹑酵母﹑非洲爪蟾等。云序生物采用 A&A Biotechnology 公司的环状 DNA 纯化柱,是绝大部分环状DNA高分文章中所使用的纯化柱,并且云序生物是该品牌在国内的唯一总代理。今年,云序生物又在港中大著名教授卢煜明(Y.M. Dennis Lo)发表的 Tn5 转座酶法的基础上,在全国范围内率先推出了血清血浆 eccDNA 甲基化测序服务。
云序生物 eccDNA 相关产品
云序生物服务优势
优势一:国内首家提供 eccDNA 测序服务和eccDNA 甲基化测序的公司。
优势二:国内提供 eccDNA 相关服务产品线最全的公司。
优势三:采用 A&A Biotechnology 环状 DNA 纯化柱,eccDNA 纯化效果好。
优势四:一站式服务:您只需按照送样要求向云序生物寄送样品,我们就能为您完成从 eccDNA 提取,文库制备,上机测序到数据分析整套服务流程。
优势五:严格质控流程:云序生物质控流程严格,层层把关,为客户提供高准确度的结果。
优势六:专业化生物信息分析:云序生物强大生物信息团队,满足客户个性化数据分析要求。
往期回顾
全国首发!云序再推eccDNA重磅新品:eccDNA甲基化测序!
Cancer Cell研究新进展:eccDNA调控癌基因转录
再登Nature Genetics:ecDNA与致癌基因扩增及多种癌症不良预后相关
Nature Genetics 揭示eccDNA新功能—驱动神经母细胞瘤基因组重排
颠覆性发现:癌基因不在染色体上环状DNA连登Nature,Cell!
