
蛋白质磷酸化是最重要的翻译后修饰(PTM)之一,广泛参与信号转导、生长发育等几乎所有生理过程中;此外大量研究证实,异常磷酸化修饰是引发动植物病变的重要原因,深入探究磷酸化变化对揭示生命活动、疾病发病机制等非常重要。 2019、2020年连续多篇蛋白基因组热点研究的研究报道中,利用高通量蛋白组、磷酸化组技术,描绘大队列组织样本的蛋白质组表达和磷酸化蛋白质组表达变化,实现了疾病分型,进一步发现了精准治疗新靶点。因此,大规模、大样本的磷酸化修饰组学解决方案必将成为未来磷酸化研究的主要方向之一。 今天给大家带来的研究成果是自中国台湾中央研究院的陈玉如教授课题组优化的一种磷酸化高深度研究的新策略——基于DIA-MS构建的全局磷酸化蛋白质组学(Global Phosphoproteomics System,GPS)。采用此方法,人细胞样本单次2h上机可检测到36350个磷酸化位点,与传统的耗时40天,采集270个数据,获得38229个磷酸化位点的方法比,效率显著提升。 主要结果 2. 基于GPS谱图库的DIA磷酸化定量准确性测试 为了评价新策略鉴定磷酸化位点定位和定量的准确性,作者合成了166条与肺癌信号通路相关的磷酸化肽段进行检测分析。实验表明,DIA策略构建的谱图库具有很高的质量,可实现位点的精确定位和准确定量。 3. 基于GPS谱图库的DIA磷酸化定量的重现性测试 接着,作者比较了常规DDA、分级的DDA、无需建库的dirDIA和GPS-libDIA四种方法在磷酸化蛋白质组覆盖率、CV% 和单针三重复DIA数据完整性三方面的差异。结果发现:(1)libDIA鉴定到的磷酸化位点数量接近DDA(RP),明显优于DDA和dirDIA;(2)libDIA和dirDIA结果的定量CV值均小于DDA;(3)libDIA 和 dirDIA 的缺失值显著少于DDA 。这些结果表明DIA的数据质量更佳,重现性更好,更适合大样本量的蛋白组学分析。 图3. DIA和DDA的比较 4. 应用1:用于肺癌细胞耐药机制研究 应用全新的DIA 定量策略比较TKI 敏感的 PC9 细胞和耐TKI的CL68细胞在磷酸化水平上的差异,共6例样本鉴定到30138个磷酸化位点。对其中16199个I类磷酸化位点,4122个磷酸化蛋白进行差异分析、皮尔逊相关性系数分析、KEGG分析、激酶分析、motif分析等,揭示了NSCLC的耐药机制。 图4. 肺癌细胞耐药机制分析 5. 应用2:用于肺癌组织中深度磷酸化蛋白质组分析 应用全新的DIA 定量策略比较癌和癌旁组织在磷酸化水平上的差异,共10例样本鉴定到32,407 个磷酸化位点。高深度的鉴定、全方位的分析,为潜在的药物靶点提供了新的方向。
1. 基于DIA-MS构建全局磷酸化蛋白质组学流程
以非小细胞肺癌为例,作者使用多个NSCLC细胞系和癌组织,结合DDA和DIA两方面的数据,构建全局性的混合磷酸化蛋白谱图库。该库共包含了88107个磷酸化位点,对比单一样本仅采用DDA方法建立的库,数据量提升超过50%。基于此库,采用DIA采集模式,单个人细胞样本可检测到36350个磷酸化位点,可实现超高深度的检测。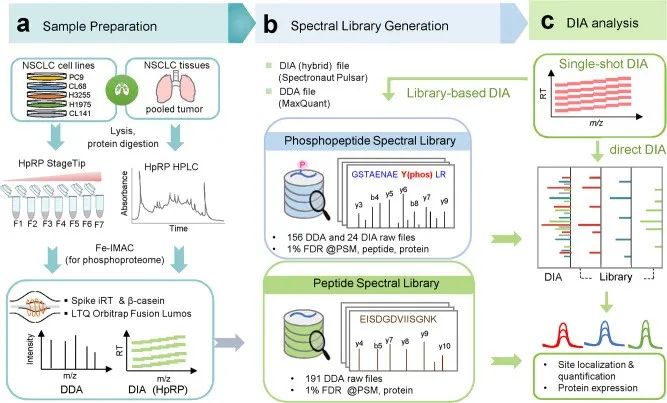
图1. 混合谱图库的构建及磷酸化定量实验流程
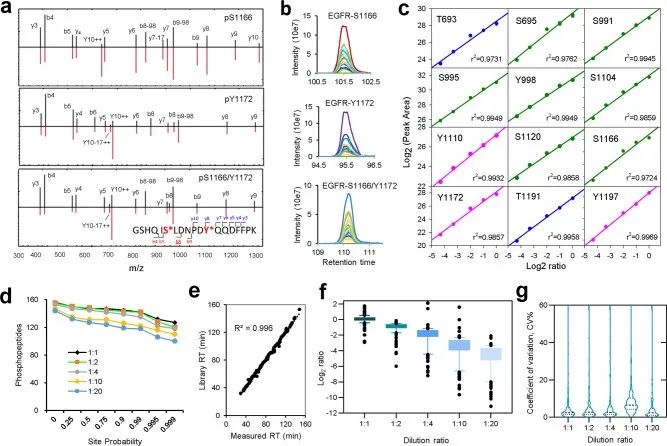
图2. DIA策略的定性及定量准确性测试
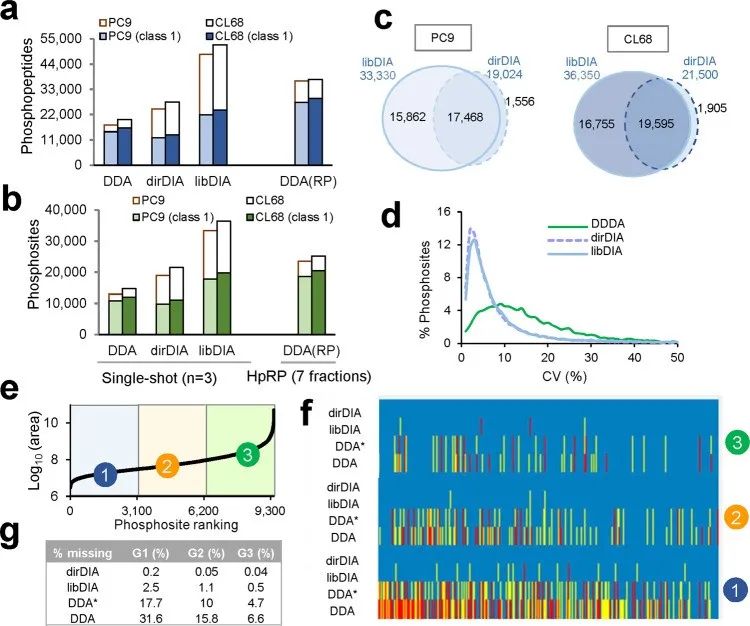
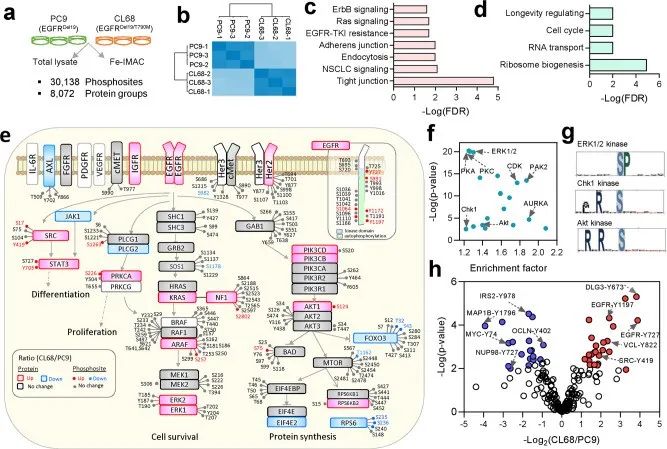
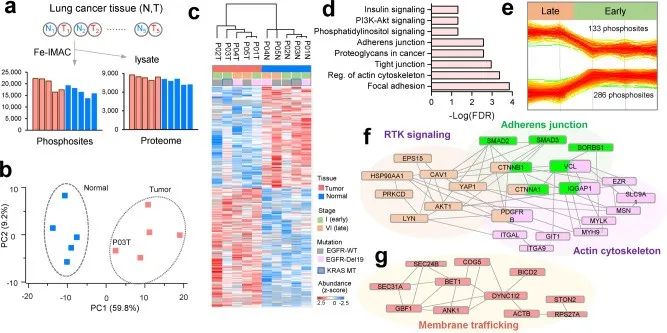
图5. 肺癌磷酸化蛋白质组分析
本文给大家介绍了磷酸化研究的新方法,该方法在检测深度和检测效率之间找到了平衡点,同时鉴定的结果中可量化可覆盖的磷酸肽段范围显著增加。加上此方法具有较低的CV值和更高的可重复性,相信未来能够极大助力磷酸化蛋白功能和机制的研究。
中科优品推荐

