【干货】小鼠肿瘤模型那些事儿
导语
嗨,小伙伴们晚上好啊!首先呢,小编想问大家一个问题,咱们天天挂在嘴边的小鼠肿瘤模型到底是怎么构建的呢?每种模型的特点是什么?最优秀的模型又属哪一个?.....其实吧,要说模型佼佼者,当然是越能体现人类疾病的发生和发展就越好,毕竟,“坚持以人为本”才是我们的最终目的!
但话说回来,每种模型都有其优劣,没有哪种模型能为我们解答所有问题, 因此,了解各类模型的特点,就变得尤为重要。以下,小编就几类比较普遍使用的小鼠肿瘤模型做一简单概况。
致癌物诱导的肿瘤模型
1915年,日本病理学家Katsusaburo Yamagiwa和其助理Koichi Ichikawa通过把煤焦油涂于兔子的耳朵(150天)上,最后,他们发现兔子罹患了肿瘤。Yamagiwa的兔子模型也被认为是首例用于癌症研究的动物模型[2]。
加利福尼亚大学旧金山分校(University of California, San Francisco)的肿瘤生物学家Melissa Reeves等人采用这种方法,在小鼠皮肤局部涂抹名为DMBA和TPA的已知致癌物,诱导小鼠发生皮肤癌,进而研究肿瘤如何从原发部位转移至继发部位。她的研究结果表明,皮肤癌不会按顺序从一个位置迁移到另一个位置——例如,从皮肤到淋巴结再到肺,而是“通过平行传播,同时进入淋巴结和肺部”[2]。
化学致癌物质可能会在数百个位点破坏DNA,而这种模型模拟了由广泛基因损伤引起的肿瘤的自然演变,这对于模拟因重复暴露于特定环境(如持续紫外照射)的人类肿瘤具有非常重要的借鉴意义,但该类模型费时较长,肿瘤的连续监测困难,高异质性可能会造成数据的处理难度增加,缺乏明确的基因操作等[2]。

图1 论防晒的重要性[1]
基因工程小鼠模型(GEMM)
顾名思义,GEMM(Genetically engineered mouse model)是通过对小鼠基因进行改造而构建的肿瘤模型,改造手段包括转座子技术,基于同源重组(或非同源末端连接)的胚胎干细胞和CRISPR-Cas9技术等。
如敲除小鼠抑癌基因p53,其罹患肿瘤的概率也会随之增加,并且这些自发肿瘤完全保留了其异质性,可以更好地模拟人类癌症特征,但另一方面,这类基因敲除通常会诱发多系统肿瘤,自发成瘤周期也因小鼠个体差异难以保持同步, 并且GEM通常只包含一两个基因改变,而人类肿瘤一般有多个基因突变等....
说到这,问题来了,既然以上所言的小鼠模型不甚如人意,那么现在研究者们普遍使用的肿瘤模型又有哪些呢? 主要有以下几种:
同系移植小鼠模型
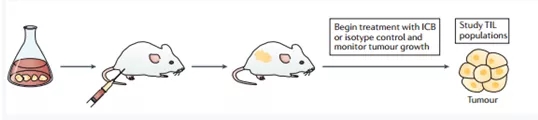
Figure2 | Transplantable mouse cancers. Strategies for developing immune checkpoint blockers (ICBs) (part a). In the standard transplantable model, histocompatible cancer cell lines are injected into immunocompetent inbred mice(usually subcutaneously into the flank). After a few days, developing tumours are palpable and experimental immunotherapy with ICBs can commence (for example, every 3 days for 15 days) with regular monitoring of tumour growth. Tumour-infiltrating lymphocyte (TIL) populations may be studied from harvested tumours at the end of the observation period (for example, to investigate treatment-related immune effects).[3]
同系移植小鼠模型(syngeneic model)是将组织相容性的肿瘤细胞系,即同种背景来源的肿瘤细胞系接种至免疫健全的近交系小鼠(通常为C57BL/6 or BALB/c strains)体内,接种部位常为皮下(方便直接观察肿瘤的生长情况),原位(模拟肿瘤生长的源环境),系统注射(腹腔或静脉注射,监测肿瘤的扩散情况),如图2。
该模型操作简单,成本低,可重复,肿瘤生长迅速且趋于同步,但接种的肿瘤通常来源于体外培养的同质性癌细胞,并且缺乏人源肿瘤生长的微环境。
小鼠肿瘤毕竟产自小鼠,既然我们的最终目的是“以人为本”,那直接进行人源肿瘤移植岂不更佳?至于免疫排斥嘛, 人类已经找到了多种自发免疫缺陷小鼠,可以用于移植人源肿瘤细胞,并且现在基因编辑技术如此火爆,重度免疫缺陷小鼠也完全是小case了好嘛~
人源肿瘤异种移植模型

CDX
人源肿瘤细胞系异种移植(cell derived xenograft, CDX),即将体外传代培养的肿瘤细胞接种至免疫缺陷小鼠,接种部位常为皮下,静脉或原位,如图3。
细胞系模型以体外培养的传代肿瘤细胞在免疫缺陷鼠体内接种而建立,由于细胞体外长期传代而呈现有高同源性特点,模型建立容易,重复性好,在肿瘤药物研发中仍有极大需求, 但在体外不断培养传代过程中,肿瘤异质性与原始肿瘤组织存在较大的差异,从而在预测临床药效方面不甚理想。
PDX
人源肿瘤组织来源移植瘤模型 (patient derived xenograft ,PDX),通过将病人新鲜的瘤组织直接移植到免疫缺陷小鼠体内而建立的肿瘤模型,常见接种部位为皮下,静脉,原位, 如图3。
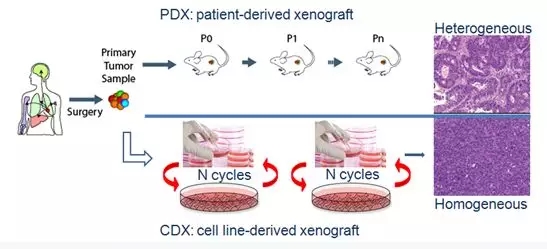
图3 CDX与PDX
与CDX相比,PDX移植所用标本直接来源于人体肿瘤组织,未经过体外培养,稳定地保留了肿瘤的遗传特性、组织学和表型特征,即肿瘤异质性,肿瘤的生长微环境更接近人体实际情况,筛药试验结果也具有较好的临床预见性。(详情参见往期推文:PDX与CDX)
但问题又来了,人体罹患的大部分肿瘤并不是在免疫缺失的情况下发生的,而为了防止接种的人源肿瘤在小鼠体内发生免疫排斥,CDX,PDX构建的小鼠模型又必须要求免疫缺陷。
有没有一种既包含人体免疫系统,又可接纳人源肿瘤的小鼠模型呢?
答案是:当然有!
目前应用于临床前的免疫系统重建技术主要分为两类:一是将成熟的人外周血单核细胞(hPBMC)通过腹腔或者尾静脉注入免疫缺陷小鼠体内重建人的免疫系统,即hPBMC型;另一类是将人骨髓衍生的CD34+造血干细胞(HSC)通过腹腔或者尾静脉注入免疫缺陷小鼠,即HSC(CD34+)型[4].(详情参见往期推文:人类免疫系统重建-助力医学研究)
今天小编就先跟大家说到这啦,想要了解更多更细致的小鼠肿瘤模型的小伙伴们,记得继续关注我们哦~
参考资料
[1] https://www.soogif.com/compress
[2] Mike May. (2018) Cancer research with a human touch. Nature, 556: 259-261.
[3] Zitvogel L, Pitt JM, et al. Mouse models in oncoimmunology. Nat Rev Cancer. 2016 Dec;16(12):759-773.
[4] Walsh NC, Kenney LL,et al. Humanized Mouse Models of Clinical Disease. Annu Rev Pathol. 2017 Jan 24;12:187-215.
